Titrimètre, un atout maître

Ce 30 septembre 2025, nous avons pu assister à une démonstration au laboratoire de chimie du bord de la mesure de l’alcalinité, avec l’intervention de Manon Mastin, ingénieure de recherche à l’Ifremer.
Après l’échantillonnage par la rosette le long de la colonne d’eau et les prélèvements réalisés sur le pont, certains échantillons peuvent être analysés à bord. Il s’agit des prélèvements pour la mesure de l’alcalinité totale et de la concentration en carbone inorganique dissous (CID). Ces échantillons sont conservés dans un bain thermostaté à 25°C, afin d’être le plus fidèle à la température de travail de l’électrode.
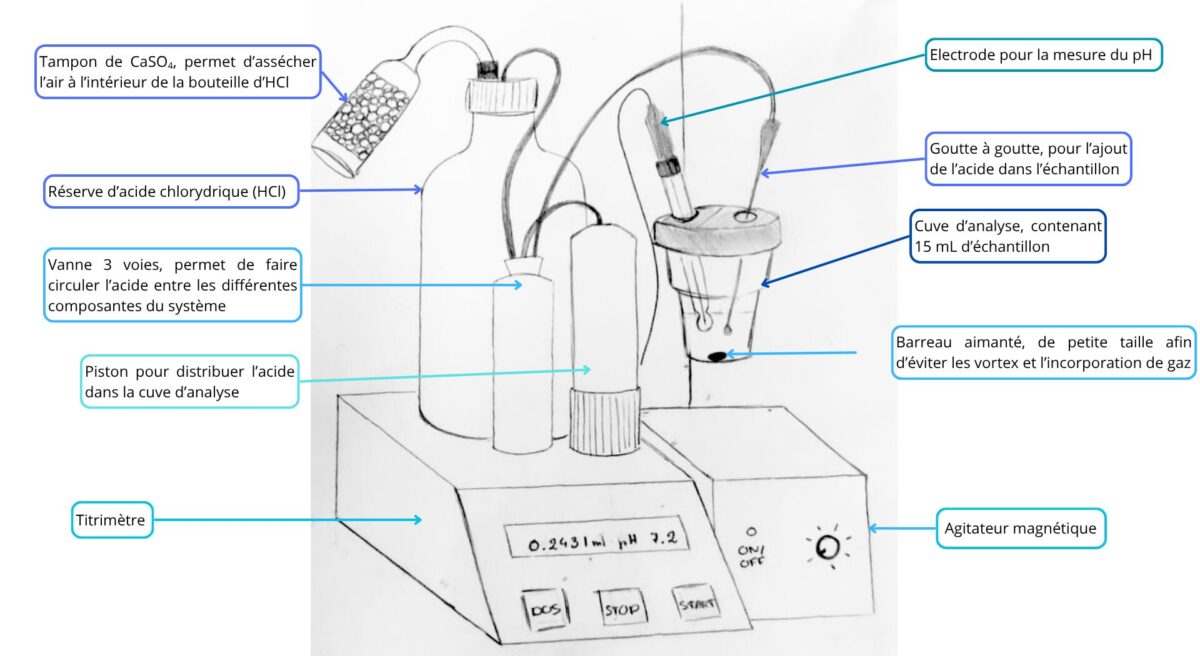
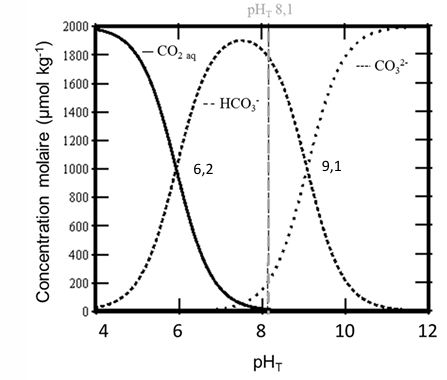
L’alcalinité d’une eau est représentative de sa concentration en différents ions alcalins, comme le calcium (Ca2+) ou le potassium (K+), et se mesure par titrimétrie. Le principe est simple : l’eau de mer prélevée a un pH oscillant entre 7,6 et 8,1 selon la profondeur d’échantillonnage, ce qui correspond à une dominance de dioxyde de carbone (CO2) particulière (Figure 2).
Figure 2. Diagramme de prédominance montrant l’espèce majoritaire dans la solution en fonction du pH.
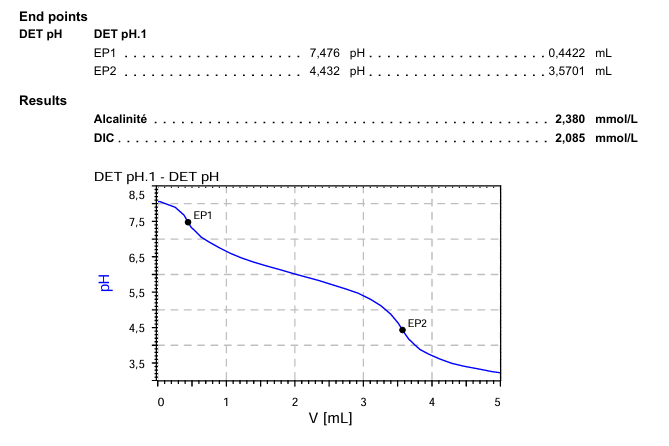
L’ajout régulier d’acide chlorhydrique (Figure 1) va faire baisser le pH de la solution, ce qui va changer l’espèce prédominante dans celle-ci. Ce changement d’espèce prédominante se fait au niveau du point d’équivalence, qui correspond à un volume équivalent d’acide ajouté et qui est atteint quand la quantité d’ions titrés est neutralisé par l’acide (Figure 3). Cette information permet ensuite de revenir à la concentration de l’espèce considérée dans la solution initiale.
Figure 3. Fichier résultat d’une analyse d’alcalinité, composé de la courbe de titrage pH-métrique (pH en fonction du volume d’acide ajouté) et des résultats d’alcalinité et de CID correspondants. Les points d’équivalence sont caractérisés par une rupture de pente indiquant une diminution rapide du pH.
Quinze millilitres d’échantillons sont prélevés et déposés dans la cuve d’analyse, ainsi qu’un mini-agitateur magnétique (Figure 1). L’utilisation d’un petit agitateur permet d’homogénéiser la solution sans créer de tourbillons, et donc d’éviter la modification artificielle des concentrations en gaz dissous. Une eau de référence est passée en début, au milieu et à la fin de l’analyse, afin de déterminer une éventuelle variation due à l’appareil de mesure et ainsi permettre une correction. Pour le premier échantillon, un réplicat est effectué avec le pH-mètre, afin de vérifier la concordance entre les instruments.
Enquête et dessin réalisés par Lucie
 Attention, vous utilisez un navigateur peu sûr !
Attention, vous utilisez un navigateur peu sûr !